
Table des matières:
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Transcription
- Divisez chaque % par l'atome Masse de l'élément.
- Divisez chacune de CES réponses par la plus petite.
- Ajustez ces nombres dans leur rapport de nombres entiers le plus bas.
Alors, comment trouvez-vous la formule empirique avec les pourcentages ?
la masse de chaque élément = le pourcentage donné. Convertissez la masse de chaque élément en moles en utilisant la masse molaire du tableau périodique. Divisez chaque valeur de mole par le plus petit nombre de moles calculé. Arrondissez au nombre entier le plus proche.
Par la suite, la question est, comment trouvez-vous la formule empirique de la combustion ? Calculez le formule empirique du composé à partir des grammes de carbone, d'hydrogène et d'oxygène. Calculez le formule masse pour le formule empirique et diviser la masse moléculaire donnée par le formule empirique masse pour obtenir n. Multipliez chacun des indices dans le formule empirique par n pour obtenir la molécule formule.
De même, vous pouvez demander, comment déterminez-vous la formule empirique ?
Calcul d'une formule empirique
- Étape 1: Obtenez la masse de chaque élément présent en grammes. Élément % = masse en g = m.
- Étape 2: Déterminez le nombre de moles de chaque type d'atome présent.
- Étape 3: Divisez le nombre de moles de chaque élément par le plus petit nombre de moles.
- Étape 4: Convertissez les nombres en nombres entiers.
Quelle est la formule empirique de la caféine ?
C'est le formule empirique . Problème n°4: Caféine a la composition en pourcentage suivante: carbone 49,48 %, hydrogène 5,19 %, oxygène 16,48 % et azote 28,85 %.
Empirique et moléculaire Formules.
| carbone: | 8 |
|---|---|
| oxygène: | 2 |
| azote: | 4 |
Conseillé:
Comment trouvez-vous la formule empirique avec des pourcentages ?

Transcription Divisez chaque % par la masse atomique de l'élément. Divisez chacune de CES réponses par la plus petite. Ajustez ces nombres dans leur rapport de nombres entiers le plus bas
Comment écrire une formule de distance en Java ?

1.Le programme Java utilisant des valeurs standard importe java. lang. Math. *; classe DistanceBwPoint. public static void main(String arg[]) {int x1,x2,y1,y2; double écran; x1=1;y1=1;x2=4;y2=4; dis=Math. sqrt((x2-x1)*(x2-x1) + (y2-y1)*(y2-y1));
Comment écrire une équation quadratique en C++ ?
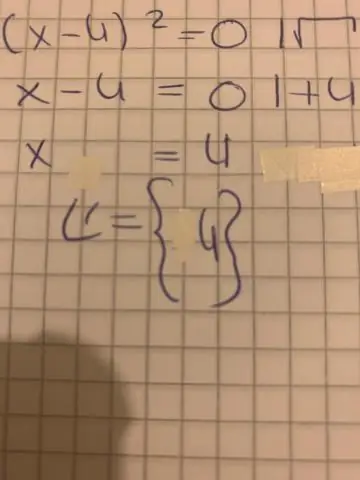
Programme 2 : trouver a b et c dans une équation quadratique #include #include int main(){float a,b,c; float d,root1,root2; printf('Entrez l'équation quadratique au format ax^2+bx+c : '); scanf('%fx^2%fx%f',&a,&b,&c); d = b * b - 4 * a * c;
Les viscosités des magmas augmentent-elles avec l'augmentation des pourcentages de silice ?

Les viscosités des magmas augmentent avec l'augmentation des pourcentages de silice. Les éruptions des volcans hawaïens peuvent être décrites comme explosives par rapport à l'éruption du mont St. Helens en 1980. Les laves basaltiques sont généralement plus chaudes et plus visqueuses que les laves andésite
Qu'est-ce que la formule empirique et la formule moléculaire?
Les formules moléculaires vous indiquent le nombre d'atomes de chaque élément dans un composé, et les formules empiriques vous indiquent le rapport le plus simple ou le plus réduit d'éléments dans un composé. Si la formule moléculaire d'un composé ne peut plus être réduite, alors la formule empirique est la même que la formule moléculaire
