Table des matières:
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Formules moléculaires vous dire combien d'atomes de chaque élément sont dans un composé, et formules empiriques vous indiquer le rapport le plus simple ou le plus réduit d'éléments dans un composé. Si un composé formule moléculaire ne peut plus être réduite, alors le formule empirique est le même que le formule moléculaire.
Simplement, comment trouvez-vous la formule moléculaire à partir de la formule empirique ?
Divisez la masse molaire du composé par le formule empirique Masse. Le résultat doit être un nombre entier ou très proche d'un nombre entier. Multipliez tous les indices dans le formule empirique par le nombre entier trouvé à l'étape 2. Le résultat est le formule moléculaire.
quelle est la formule empirique d'un composé dont la formule moléculaire est s6o9 ? si la la formule moléculaire est S6O9 pour obtenir le formule empirique on cherche un nombre qui divisera en 6 et 9 à cinq le plus petit rapport des nombres entiers (qui est la définition de formule empirique !).
Simplement, comment trouvez-vous la formule moléculaire à partir de la formule empirique et de la masse molaire ?
Formule empirique poids = (1 x 12,01g/mol) + (2 x 1,01g/mol) + (1 x 16,00g/mol) = 30,02g/mol. Divisez le masse molaire pour le formule moléculaire par le masse de formule empirique . Le résultat détermine combien de fois multiplier les indices dans le formule empirique pour obtenir le formule moléculaire.
Comment résolvez-vous pour la formule empirique?
Calcul d'une formule empirique
- Étape 1: Obtenez la masse de chaque élément présent en grammes. Élément % = masse en g = m.
- Étape 2: Déterminez le nombre de moles de chaque type d'atome présent.
- Étape 3: Divisez le nombre de moles de chaque élément par le plus petit nombre de moles.
- Étape 4: Convertissez les nombres en nombres entiers.
Conseillé:
Pourquoi la formule empirique de l'oxyde de magnésium est-elle MgO ?

La formule empirique de l'oxyde de magnésium est MgO. Le magnésium est un cation +2 et l'oxyde est un anion -2. Étant donné que les charges sont égales et opposées, ces deux ions se lieront dans un rapport d'atomes de 1 à 1
Quelle est la formule empirique de l'octane ?

C8H18 Ici, quelle est la formule empirique de l'octane c8h18 ? Les formule empirique de l'octane $$C_{8}H_{18}$$ est: A. B. C. De même, quelle est la formule empirique de c2h6o2 ? Formules moléculaires et empiriques Question Réponse Écrivez la formule empirique du composé suivant:
Quelle est la formule empirique de la caféine ?
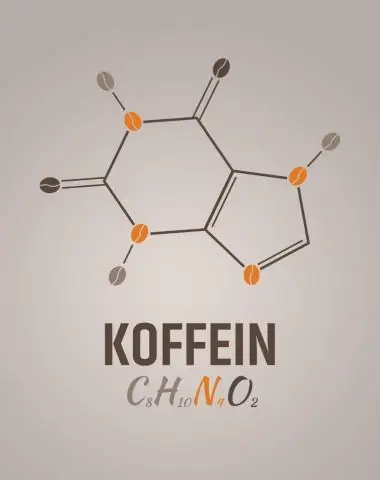
2 réponses. C8H10N4O2 est la formule moléculaire de la caféine
Quelle est la formule empirique du bromure de strontium ?

SrBr2 Alors, quelle est la formule du bromure de strontium ? SrBr2 De plus, le bromure de strontium est-il aqueux ? Sur Bromure de strontium Hexahydrate Les formes ultra haute pureté, haute pureté, submicronique et nanopoudre peuvent être envisagées.
Qu'est-ce qu'une formule structurelle Quelle est la différence entre une formule structurelle et un modèle moléculaire ?
Une formule moléculaire utilise des symboles chimiques et des indices pour indiquer le nombre exact d'atomes différents dans une molécule ou un composé. Une formule empirique donne le rapport en nombre entier le plus simple d'atomes dans un composé. Une formule structurelle indique l'arrangement de liaison des atomes dans la molécule
