
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-06-01 05:04.
La présence de seulement certaines raies dans l'atome spectres signifiait qu'un électron ne peut adopter que certains niveaux d'énergie discrets (l'énergie est quantifiée); d'où l'idée de quantique coquilles . Les fréquences photoniques absorbées ou émis par un atome sont fixés par les différences entre les niveaux d'énergie des orbites.
À ce sujet, comment le modèle de Bohr a-t-il pris en compte les spectres d'émission des atomes ?
le modèle de Bohr de l'hydrogène atome a donné une explication exacte pour son observation Spectre d'émission . Les électrons peuvent se déplacer d'une orbite à une autre en absorbant ou en émettant de l'énergie, donnant lieu à des caractéristiques spectres.
quelles preuves soutiennent le modèle de Bohr ? Modèle Bohr et spectres atomiques preuve habitué soutenir le modèle Bohr provenait du spectre atomique. Bohr ont suggéré qu'un spectre atomique est créé lorsque les électrons d'un atome se déplacent entre les niveaux d'énergie.
À cet égard, quelles preuves y a-t-il pour les électrons dans les coquilles ?
Énergie d'ionisation - la preuve pour coquilles et sous- coquilles L'énergie d'ionisation est une mesure de les quantité d'énergie nécessaire pour éliminer électrons à partir d'atomes. Comme électrons sont chargés négativement et les protons dans les le noyau est chargé positivement, là sera une attraction entre eux.
Comment trouve-t-on le spectre d'émission ?
Les fréquences de la lumière qu'un atome peut émettre dépendent des états dans lesquels les électrons peuvent se trouver. Lorsqu'il est excité, un électron se déplace vers un niveau d'énergie ou une orbitale plus élevé. Lorsque l'électron retombe à son niveau du sol, la lumière est émis.
Conseillé:
Quelles sont les causes des raies dans le spectre d'émission des éléments ?

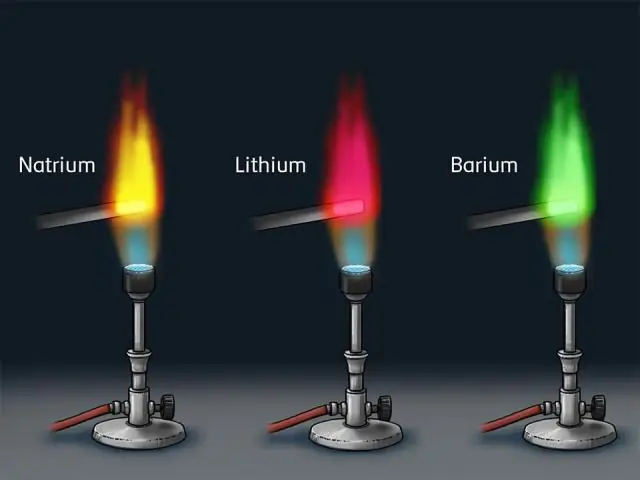
Les raies d'émission se produisent lorsque les électrons d'un atome, d'un élément ou d'une molécule excités se déplacent entre les niveaux d'énergie, retournant vers l'état fondamental. Les raies spectrales d'un élément ou d'une molécule spécifique au repos dans un laboratoire se produisent toujours aux mêmes longueurs d'onde
Comment prouver que les droites sont parallèles dans les preuves ?

La première est que si les angles correspondants, les angles qui sont sur le même coin à chaque intersection, sont égaux, alors les lignes sont parallèles. La seconde est si les angles intérieurs alternés, les angles qui sont sur les côtés opposés de la transversale et à l'intérieur des lignes parallèles, sont égaux, alors les lignes sont parallèles
Comment sont les preuves des spectres d'émission pour les couches d'électrons?

La présence de certaines raies seulement dans les spectres atomiques signifiait qu'un électron ne peut adopter que certains niveaux d'énergie discrets (l'énergie est quantifiée); d'où l'idée de coques quantiques. Les fréquences des photons absorbés ou émis par un atome sont fixées par les différences entre les niveaux d'énergie des orbites
Comment Niels Bohr a-t-il décrit les électrons dans son modèle atomique ?
Modèle atomique de Bohr : En 1913, Bohr a proposé son modèle de coquille quantifié de l'atome pour expliquer comment les électrons peuvent avoir des orbites stables autour du noyau. L'énergie d'un électron dépend de la taille de l'orbite et est plus faible pour les orbites plus petites. Le rayonnement ne peut se produire que lorsque l'électron saute d'une orbite à une autre
Comment le modèle de Bohr explique-t-il les spectres atomiques ?

Niels Bohr a expliqué le spectre de raies de l'atome d'hydrogène en supposant que l'électron se déplaçait sur des orbites circulaires et que les orbites avec seulement certains rayons étaient autorisées. L'orbite la plus proche du noyau représentait l'état fondamental de l'atome et était la plus stable; les orbites plus éloignées étaient des états excités à plus haute énergie
