
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Niels Bohr a proposé le Modèle Bohr du Atome en 1915. Le Modèle Bohr est un planétaire maquette dans lequel les électrons chargés négativement orbitent autour d'un petit noyau chargé positivement semblable aux planètes en orbite autour du soleil (sauf que les orbites ne sont pas planes).
Ici, quel est le modèle atomique de Niels Bohr ?
Modèle atomique Les modèle Bohr montre le atome comme un petit noyau chargé positivement entouré d'électrons en orbite. Bohr a été le premier à découvrir que les électrons se déplacent sur des orbites distinctes autour du noyau et que le nombre d'électrons dans l'orbite externe détermine les propriétés d'un élément.
De même, quels sont les 4 postulats de Bohr ? Postulats de de Bohr Modèle d'un atome: Dans un atome, les électrons (chargés négativement) tournent autour du noyau chargé positivement dans un chemin circulaire défini appelé orbites ou coquilles. 2. Chaque orbite ou coquille a une énergie fixe et ces orbites circulaires sont appelées coquilles orbitales.
De plus, comment Bohr a-t-il affiné le modèle de l'atome ?
En 1913 Bohr a proposé sa coquille quantifiée modèle de l'atome pour expliquer comment les électrons peuvent avoir des orbites stables autour du noyau. Pour remédier au problème de stabilité, Bohr modifié le Rutherford maquette en exigeant que les électrons se déplacent sur des orbites de taille et d'énergie fixes.
Quels sont les quatre principes du modèle de Bohr ?
Les modèle Bohr peut se résumer par ce qui suit quatre principes : Les électrons n'occupent que certaines orbites autour du noyau. Ces orbites sont stables et sont appelées orbites "stationnaires". Chaque orbite est associée à une énergie.
Conseillé:
Quel est le premier modèle atomique ?

Le modèle de l'atome de Rutherford (ESAAQ) Rutherford a réalisé quelques expériences qui ont conduit à un changement d'idées autour de l'atome. Son nouveau modèle décrit l'atome comme un noyau minuscule, dense et chargé positivement appelé noyau entouré d'électrons plus légers et chargés négativement
Comment Bohr a-t-il amélioré le modèle atomique de Rutherfords ?

Bohr a amélioré le modèle atomique de Rutherford en proposant que les électrons se déplacent sur des orbites circulaires avec des niveaux d'énergie spécifiques. Explication : Rutherford a proposé que les électrons entouraient le noyau comme des planètes autour du soleil. Lorsqu'un atome de métal est chauffé, il absorbe de l'énergie et les électrons sautent à des niveaux d'énergie plus élevés
Quelle est l'orbite stable dans le modèle atomique de Bohr ?

Un atome a un certain nombre d'orbites stables dans lesquelles un électron peut résider sans émission d'énergie rayonnante. Chaque orbite correspond, à un certain niveau d'énergie. 4. Une surface spéciale autour du noyau qui contenait des orbites d'énergie et de rayon égaux s'appelait la coquille
Quel modèle atomique indique qu'il est impossible de connaître l'emplacement exact des électrons autour du noyau ?

La réponse est le modèle de nuage d'électrons. Le modèle d'Erwin Schrodinger, contrairement aux autres modèles, montre les électrons dans le cadre d'un « nuage » où tous les électrons occupent le même espace à la fois
Comment Niels Bohr a-t-il décrit les électrons dans son modèle atomique ?
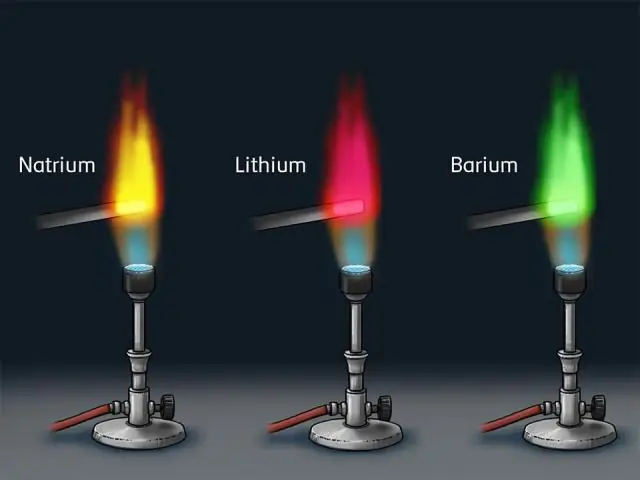
Modèle atomique de Bohr : En 1913, Bohr a proposé son modèle de coquille quantifié de l'atome pour expliquer comment les électrons peuvent avoir des orbites stables autour du noyau. L'énergie d'un électron dépend de la taille de l'orbite et est plus faible pour les orbites plus petites. Le rayonnement ne peut se produire que lorsque l'électron saute d'une orbite à une autre
