
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-06-01 05:04.
Liaison covalente est le type de liaison qui maintient ensemble les atomes d'un ion polyatomique. Il faut deux électrons pour faire un une liaison covalente , un de chaque atome de liaison. Les structures de points de Lewis sont une façon de représenter la formation des atomes des liaisons covalentes.
De même, comment combinez-vous les ions polyatomiques ?
Une autre façon de se former ions polyatomiques est par combiner les avec un ou plusieurs hydrogène ions , H+. Par exemple, nous pourrions combiner H+ avec carbonate, CO32- pour former de l'hydrogénocarbonate, HCO3-. Notez que la charge globale est de 1- car le 1+ sur H+ combiner avec le 2- sur CO32-.
On peut aussi se demander si les composés avec des ions polyatomiques sont ioniques ou covalents ? Ions polyatomiques sommes ions . Cependant, les atomes de ions polyatomiques sont maintenus ensemble par covalent obligations. Composés contenant ions polyatomiques sommes composés ioniques . La règle de base est composés ioniques avoir lieu entre un positif ionique métal et un négatif ionique non métallique.
A côté de cela, quelle combinaison d'éléments formera une liaison ionique ?
Un liaison ionique est un type de produit chimique lier formé par une attraction électrostatique entre deux charges opposées ions . Des liaisons ioniques sont formés entre un cation, qui est généralement un métal, et un anion, qui est généralement un non-métal. Un covalent lier implique qu'une paire d'électrons soit partagée entre les atomes.
Quels sont les deux éléments les plus susceptibles de se lier l'un à l'autre ?
Oxygène (O) et fluor (F) sont deux bons exemples. Chacun de ces éléments recherche quelques électrons pour former une coquille remplie. Ils ont chacun une coquille remplie de deux électrons, mais leur deuxième coquille veut en avoir huit.
Conseillé:
Quelle est la force d'attraction qui maintient les atomes ou les ions ensemble ?

Liaisons chimiques
Quels sont les ions polyatomiques courants ?

Ions polyatomiques communs Zn2+ Zinc. Cd2+ Cadmium. 1+ frais. NH4. Ammonium. Hg2. Mercure (I) Ag+ Argent. 1- charger. C2H3O2. Acétate. CN-Cyanure. ClO- Hypochlorite. ClO2. Chlorite. ClO3. Chlorate. ClO4. Perchlorate. HCO3. (bi)carbonate d'hydrogène. H2PO4
Comment lier des ions polyatomiques ?
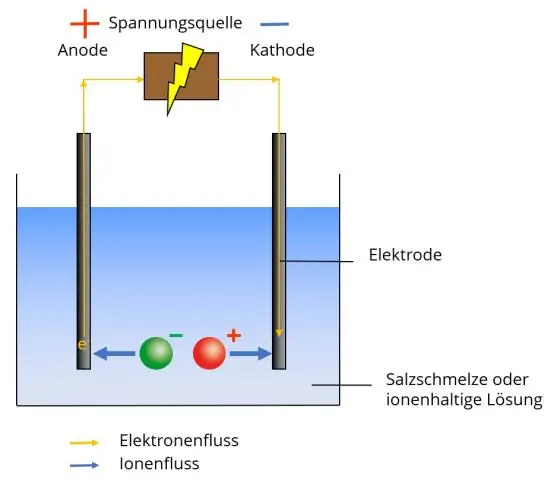
Un ion polyatomique a deux ou plusieurs atomes liés par covalence qui agissent comme un seul ion. L'ion polyatomique forme des liaisons ioniques avec d'autres ions et agit à l'extérieur comme une unité, tout comme les ions monoatomiques
Utilisez-vous des préfixes pour nommer les ions polyatomiques ?

Les ions polyatomiques ont des noms spéciaux. Beaucoup d'entre eux contiennent de l'oxygène et sont appelés oxyanions. Lorsque différents oxyanions sont constitués du même élément, mais ont un nombre différent d'atomes d'oxygène, des préfixes et des suffixes sont utilisés pour les distinguer
Comment nommez-vous les acides avec des ions polyatomiques ?

Nommer les acides Tout ion polyatomique avec le suffixe "-ate" utilise le suffixe "-ic" comme acide. Lorsque vous avez un ion polyatomique avec un oxygène de plus que l'ion "-ate", alors votre acide aura le préfixe "per-" et le suffixe "-ic". Par exemple, l'ion chlorate est ClO3–
