
Table des matières:
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
X = [Fe(SCN)2+] et doit être déterminé à partir de la courbe standard. Vous pouvez alors calculer le constante d'équilibre , Kéq , en utilisant le équilibre concentration. La courbe standard est un tracé de Absorbant par rapport à [Fe(SCN)2+] (Figure 8.1). Il peut être utilisé pour nous donner la concentration d'une solution lorsqu'on lui donne la absorbance.
En gardant cela à l'esprit, comment trouvez-vous la concentration d'équilibre à partir de l'absorbance ?
Par conséquent, [Fe(SCN)2+]éq peut être déterminé directement à partir de absorbance des mesures. Concentrations d'équilibre des réactifs peut être calculé en soustrayant le concentration d'équilibre du produit de la première concentration des réactifs.
Deuxièmement, qu'est-ce que le FeSCN ? Les FeSCN 2+ complexe formé à la suite de la réaction entre le fer (III) et les ions thiocyanate a une couleur rouge sang très intense (ou orange en solution diluée), permettant une détection facile et une détermination quantitative par spectrophotométrie. Réactifs (Fe3+ et SCN-) sont pratiquement incolores.
De cette façon, comment trouvez-vous la concentration d'équilibre à partir du tracé de la loi de Beer ?
concentration d'équilibre du produit
- [FeSCN2+] à l'équilibre est déterminé à l'aide de la loi de Beer; x est la quantité de FeSCN2+ créé (déterminé expérimentalement).
- x = [FeSCN 2+] éq =
- une.
- Utilisez l'éq.
- Trouver la valeur moyenne de Kéq, l'écart type et l'erreur relative (écart type divisé par la moyenne).
Que signifie KEQ ?
Kéq vous dit simplement ce qui sera favorisé à l'équilibre. Depuis Kéq = [produits]/[réactifs] une grande valeur de k (k>>1) signifie que la réaction favorisera beaucoup plus les produits, ce qui signifie que lorsque la réaction a atteint l'équilibre, vous aurez principalement des produits.
Conseillé:
Comment trouver la constante de proportionnalité dans un graphique ?
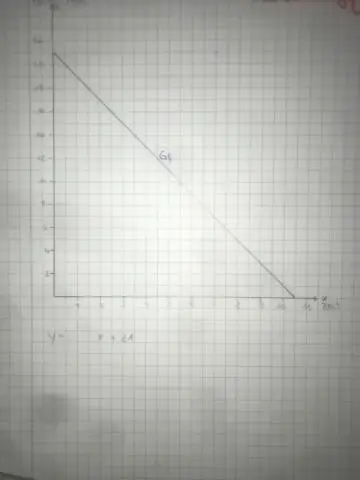
Pour trouver votre constante de proportionnalité à partir d'un graphique, suivez ces étapes : Trouvez deux points faciles. Commencez par le point le plus à gauche et comptez le nombre de cases dont vous avez besoin pour atteindre votre deuxième point. Comptez le nombre de cases dont vous avez besoin pour aller à droite. Simplifiez, et vous avez trouvé votre constante de proportionnalité
Comment trouvez-vous la molarité à partir de l'absorbance?

L'équation doit être sous la forme y=mx + b. Donc, si vous soustrayez votre ordonnée à l'origine de l'absorbance et divisez par la pente, vous trouvez la concentration de votre échantillon
Comment trouvez-vous la concentration d'ADN à partir de l'absorbance?

La concentration d'ADN est estimée en mesurant l'absorbance à 260 nm, en ajustant la mesure A260 pour la turbidité (mesurée par l'absorbance à 320 nm), en multipliant par le facteur de dilution et en utilisant la relation qu'un A260 de 1,0 = 50 µg/ml d'ADNdb pur
Qu'entend-on par constante d'équilibre et comment est-elle déterminée expérimentalement ?

Un article de Wikipédia, l'encyclopédie libre. Les constantes d'équilibre sont déterminées afin de quantifier les équilibres chimiques. Lorsqu'une constante d'équilibre K est exprimée sous forme de quotient de concentration, cela implique que le quotient d'activité est constant
Comment trouvez-vous la longueur d'onde à partir de l'absorbance?

Multipliez l par c, puis divisez A par le produit pour déterminer l'absorptivité molaire. Par exemple : À l'aide d'une cuvette d'une longueur de 1 cm, vous avez mesuré l'absorbance d'une solution avec une concentration de 0,05 mol/L. L'absorbance à une longueur d'onde de 280 nm était de 1,5
