
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
La loi d'Avogadro montre qu'il existe une relation directe entre le nombre de moles d'un gaz et sa le volume . Cela peut aussi être montré à l'aide de l'équation: V1/n1 = V2/n2. Si le nombre de moles est doublé, le le volume va doubler.
De cette façon, quelle est la formule de la loi d'Avogadro ?
La formule de la loi d'Avogadro Où « V » est le volume du gaz, « n » est la quantité de gaz (nombre de moles de gaz) et « k » est une constante pour une pression et une température données. En réalité, La loi d'Avogadro , l'hypothèse posée par lui, figurait parmi les lois sur lequel le gaz parfait Loi est basé.
De plus, quel est un exemple de la loi d'Avogadro ? La loi d'Avogadro indique que le volume d'un gaz est directement proportionnel au nombre de moles de gaz. Voilà quelque exemples . Lorsque vous faites exploser un ballon de basket, vous forcez plus de molécules de gaz à l'intérieur. Plus il y a de molécules, plus le volume est important. Les deux ballons contiennent le même nombre de molécules.
De plus, que dit la loi d'Avogadro, ce laboratoire prouve-t-il la loi ? Comment le savez-vous ?
Une déclaration moderne est : La loi d'Avogadro déclare que "des volumes égaux de tous les gaz, à la même température et pression, ont le même nombre de molécules." Pour une masse donnée d'un gaz parfait , le volume et la quantité (moles) de gaz sommes directement proportionnelle si la température et la pression sommes constant.
Comment la loi de combinaison des volumes est-elle expliquée par l'hypothèse d'Avogadro ?
(une) Loi de la combinaison des volumes par L'hypothèse d'Avogadro : Tous les gaz contenant le même volumes aux mêmes conditions externes de température et de pression auront un nombre égal de molécules. Ces molécules de gaz réagissent dans des rapports de petits nombres entiers, de sorte que leur (gaz) volumes sera également en rapport de petits nombres entiers.
Conseillé:
Comment résoudre une équation quadratique en utilisant la loi du facteur nul ?

De ceci, nous pouvons déduire que : Si le produit de deux nombres quelconques est zéro, alors un ou les deux nombres sont zéro. Autrement dit, si ab = 0, alors a = 0 ou b = 0 (ce qui inclut la possibilité que a = b = 0). C'est ce qu'on appelle la loi du facteur nul; et nous l'utilisons souvent pour résoudre des équations quadratiques
Comment trouver des racines imaginaires en utilisant la règle des signes de Descartes ?

La règle des signes de Descartes dit que le nombre de racines positives est égal aux changements de signe de f(x), ou est inférieur à celui d'un nombre pair (vous continuez donc à soustraire 2 jusqu'à ce que vous obteniez 1 ou 0). Par conséquent, le f(x) précédent peut avoir 2 ou 0 racines positives. Racines réelles négatives
Comment trouver le rayon d'un cercle en utilisant pi ?
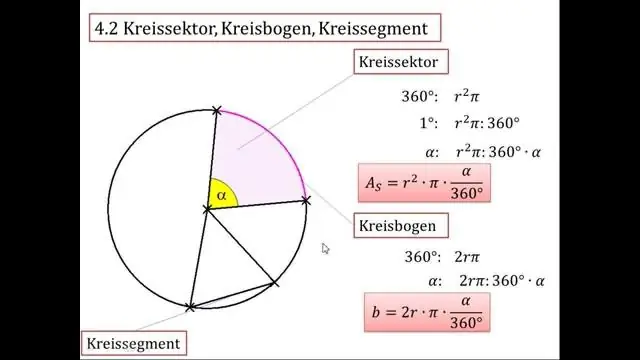
Pour calculer le rayon d'un cercle en utilisant la circonférence, prenez la circonférence du cercle et divisez-la par 2 fois π. Pour un cercle d'une circonférence de 15, vous diviseriez 15 par 2 fois 3,14 et arrondiriez la virgule à votre réponse d'environ 2,39
Comment résoudre la loi d'Avogadro ?

A pression et température constantes, la loi d'Avogadro peut être exprimée par la formule suivante : V n. V/n = k. V1/n1 = V2/n2 (= k, selon la loi d'Avogadro). PV = nRT. V/n = (RT)/P. V/n = k. k = (RT)/P. Une mole d'hélium gazeux remplit un ballon vide jusqu'à un volume de 1,5 litre
Comment démontrer la loi d'Avogadro ?

La loi d'Avogadro s'applique à chaque fois que vous gonflez un ballon. Le volume du ballon augmente au fur et à mesure que vous ajoutez des moles de gaz au ballon en le gonflant. Si le récipient contenant le gaz est rigide plutôt que flexible, la pression peut être substituée au volume dans la loi d'Avogadro
