- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
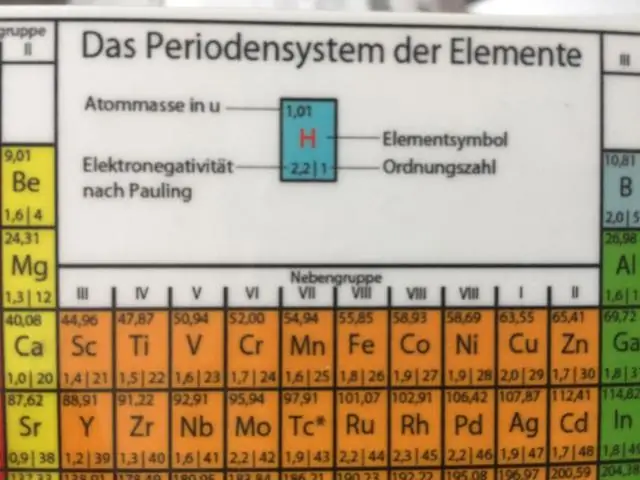
Isotopes sont définis d'abord par leur élément puis par la somme des protons et des neutrons présents. Carbone-12 (ou 12C) contient six protons, six neutrons et six électrons; par conséquent, il a un nombre de masse de 12 amu (six protons et six neutrons).
Ici, comment se forme un isotope ?
Isotopes sont des atomes d'un même élément qui ont un nombre différent de neutrons mais le même nombre de protons et d'électrons. Radioactif (instable) isotopes ont des noyaux qui se désintègrent spontanément au fil du temps pour former autre isotopes.
Deuxièmement, quels sont 3 exemples d'isotopes ? Quelques exemples d'écurie isotopes sommes isotopes de carbone, potassium, calcium et vanadium. Radioactif isotopes ont une combinaison instable de protons et de neutrons, ils ont donc des noyaux instables. Parce que ces isotopes sont instables, subissent une désintégration et, ce faisant, peuvent émettre des rayons alpha, bêta et gamma.
En conséquence, qu'est-ce qu'un isotope et un exemple ?
Définition de Isotopes . Les éléments sont définis par le nombre de protons dans le noyau atomique. Pour Exemple , un atome avec 6 protons doit être du carbone, et un atome avec 92 protons doit être de l'uranium. En plus des protons, les atomes de presque tous les éléments contiennent également des neutrons.
Qu'est-ce qu'un symbole isotopique ?
Le nucléaire symbole se compose de trois parties: la symbole de l'élément, le numéro atomique de l'élément et le nombre de masse de l'élément spécifique isotope . Voici un exemple de nucléaire symbole : L'élément symbole , Li, est celui du lithium. Le nombre de protons et de neutrons dans le noyau de l'atome.
Conseillé:
En quoi les atomes et les isotopes sont-ils similaires ?

Les atomes d'un élément chimique peuvent exister sous différents types. Ceux-ci sont appelés isotopes. Ils ont le même nombre de protons (et d'électrons), mais des nombres de neutrons différents. Différents isotopes d'un même élément ont des masses différentes
Comment sait-on que les isotopes existent ?

Les isotopes sont des atomes d'un même élément avec des masses différentes. Ils obtiennent ces différentes masses en ayant différents nombres de neutrons dans leurs noyaux. Les isotopes d'atomes présents dans la nature se présentent sous deux formes : stables et instables (radioactifs)
Comment les isotopes c12 et c14 se ressemblent-ils?

Le carbone 12 et le carbone 14 sont deux isotopes de l'élément carbone. La différence entre le carbone 12 et le carbone 14 est le nombre de neutrons dans chacun de leurs atomes. C'est ainsi que cela fonctionne. Le nombre donné après le nom de l'atome indique le nombre de protons et de neutrons dans un atome ou un ion
Comment fait-on les isotopes en chimie ?

Les isotopes sont des atomes avec le même nombre de protons mais qui ont un nombre différent de neutrons. Puisque le numéro atomique est égal au nombre de protons et que la masse atomique est la somme des protons et des neutrons, on peut aussi dire que les isotopes sont des éléments avec le même numéro atomique mais des numéros de masse différents
Comment les isotopes radioactifs sont-ils utilisés dans la datation radiométrique ?

La datation radiométrique est une méthode utilisée pour dater les roches et autres objets sur la base du taux de désintégration connu des isotopes radioactifs. Avec la datation au radiocarbone, nous voyons que le carbone-14 se désintègre en azote-14 et a une demi-vie de 5 730 ans
