
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Dans tous les types de réactions chimiques, obligations sont cassés et remontés pour former Nouveaux produits. Cependant, dans les réactions exothermiques, endothermiques et toutes les réactions chimiques, il faut énergie casser le produit chimique existant obligations et énergie est publié quand le nouveau forme d'obligations.
De plus, de l'énergie est-elle libérée lors de la formation d'une liaison ?
Énergie est absorbé pour casser obligations . Lier -la rupture est un processus endothermique. Énergie est publié quand neuf forme d'obligations . Qu'une réaction soit endothermique ou exothermique dépend de la différence entre les énergie besoin de casser obligations et le énergie libérée quand neuf forme d'obligations.
On peut aussi se demander pourquoi la formation de liaisons est-elle exothermique ? Lorsque obligations se forment, le système perd de l'énergie et augmente donc sa stabilité (qui est le motif ultime). Comme il s'agit d'une diminution d'énergie, l'énergie perdue est libérée sous forme d'énergie thermique et c'est donc un exothermique traiter.
De ce fait, les Obligations stockent-elles de l'énergie ?
L'excès énergie de 794 kJ/mol est libérée sous forme de chaleur, que nous pouvons ensuite utiliser pour cuire nos aliments, entre autres. Ainsi, la chimie les obligations font ne pas boutique ” énergie . Les énergie pour casser obligations vient seulement quand plus fort obligations sont formés à la place. Mais il faut énergie pour casser un groupe phosphate de l'ATP.
Que se passe-t-il lorsqu'une liaison chimique se forme ?
UNE liaison chimique est une attraction durable entre des atomes, des ions ou des molécules qui permet la formation de chimique composés. Les lier peut résulter de la force d'attraction électrostatique entre des ions de charges opposées comme dans les ions ioniques obligations ou par le partage d'électrons comme dans des liaisons covalentes.
Conseillé:
Quel est le processus de formation d'une solution?

Une solution est formée lorsqu'une substance appelée le soluté «se dissout» dans une autre substance appelée solvant. La dissolution se produit lorsque le soluté se sépare d'un plus gros cristal de molécules en groupes beaucoup plus petits ou en molécules individuelles. Ils le font en retirant les ions puis en entourant les molécules de sel
Quelles sont les étapes de la formation des étoiles ?
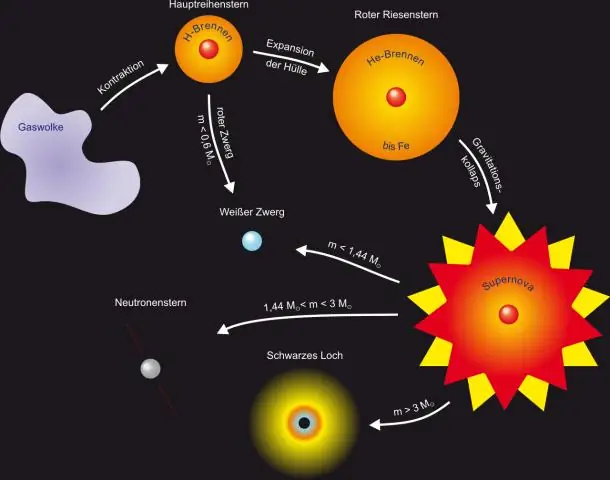
7 étapes principales d'une étoile Un nuage de gaz géant. Une étoile commence sa vie sous la forme d'un grand nuage de gaz. Une Protostar est une Baby Star. La phase T-Tauri. Étoiles de la séquence principale. Expansion dans Red Giant. Fusion d'éléments plus lourds. Supernovae et nébuleuses planétaires
D'où vient l'oxygène libéré lors de la photosynthèse ?

L'oxygène libéré lors de la photosynthèse provient de la division de l'eau lors de la réaction dépendante de la lumière. 3. N'oubliez pas que les électrons perdus du centre de réaction dans le photosystème II doivent être remplacés
Lorsque l'ARNt libère son acide aminé Que se passe-t-il ?

Le premier ARNt transfère son acide aminé à l'acide aminé sur l'ARNt nouvellement arrivé, et une liaison chimique est établie entre les deux acides aminés. L'ARNt qui a abandonné son acide aminé est libéré. Il peut alors se lier à une autre molécule de l'acide aminé et être réutilisé plus tard dans le processus de fabrication des protéines
Que libère un acide lorsqu'il est dissous ?

Les acides sont des substances qui, lorsqu'elles sont dissoutes dans l'eau, libèrent des ions hydrogène, H+(aq). Lorsqu'elles sont dissoutes, les bases libèrent des ions hydroxyde, OH-(aq) en solution. L'eau est le produit d'une réaction acide-base. Les chimistes disent que l'acide et la base s'annulent ou se neutralisent, d'où la réaction est connue sous le nom de "neutralisation"
