
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Sciences de l'environnement pour Nuls
Lorsque deux atomes se rejoignent dans un une liaison covalente , ils forment une molécule qui partage des électrons. Contrairement à l'ionique lier , aucun des atomes d'un une liaison covalente perd ou gagne un électron; au lieu de cela, les deux atomes utilisent une paire d'électrons partagés.
En outre, qu'est-ce que les termes simples de liaison covalente?
Des liaisons covalentes sont chimiques obligations entre deux atomes non métalliques. Un exemple est l'eau, où l'hydrogène (H) et l'oxygène (O) lier ensemble pour faire (H2O). Une enveloppe extérieure complète a généralement huit électrons, ou deux dans le cas de l'hydrogène ou de l'hélium. Des liaisons covalentes sont formés par des atomes partageant des électrons de valence.
Par la suite, la question est, qu'est-ce qu'une liaison ionique pour les nuls ? Sciences de l'environnement pour Nuls Pour former des molécules, les atomes doivent échanger ou partager des électrons de leur enveloppe électronique externe pour créer des atomes atomiques. obligations . Un liaison ionique se produit lorsqu'un atome donne un électron à un autre atome. Les atomes ainsi liés entre eux sont appelés ionique composés.
Simplement, comment décrivez-vous une liaison covalente?
UNE une liaison covalente , également appelé molécule lier , est un produit chimique lier qui implique le partage de paires d'électrons entre les atomes. Ces paires d'électrons sont appelées paires partagées ou liaison paires, et l'équilibre stable des forces attractives et répulsives entre les atomes, lorsqu'ils partagent des électrons, est connu sous le nom liaison covalente.
Qu'est-ce qu'une liaison covalente et donne des exemples ?
Exemples de composés qui ne contiennent que des liaisons covalentes sont du méthane (CH4), le monoxyde de carbone (CO) et le monobromure d'iode (IBr). Liaison covalente entre les atomes d'hydrogène: étant donné que chaque atome d'hydrogène a un électron, ils sont capables de remplir leurs couches les plus externes en partageant une paire d'électrons à travers un une liaison covalente.
Conseillé:
NaCl contient-il une liaison covalente non polaire ?

Oui, NaCl est une liaison ionique qui le rend polaire. La différence d'électronégativité est ce qui rend une liaison polaire ou non polaire. Si deux atomes dans une liaison ont la même électronégativité (par exemple, qui se compose de deux atomes identiques), la liaison est non polaire car les deux atomes ont une attraction égale pour les électrons
En quoi une liaison covalente est-elle différente d'un quizlet sur les liaisons ioniques ?

La différence entre une liaison ionique et une liaison covalente est qu'une liaison covalente se forme lorsque deux atomes partagent des électrons. Les liaisons ioniques sont des forces qui maintiennent ensemble les forces d'attraction électrostatiques entre des ions de charges opposées. Les liaisons ioniques ont une différence d'électronégativité supérieure ou égale à 2
Une liaison hydrogène est-elle la même chose qu'une liaison covalente?

La liaison hydrogène est le nom donné à l'interaction électrostatique entre la charge positive sur un atome d'hydrogène et la charge négative sur l'atome d'oxygène d'une molécule voisine. La liaison covalente est l'interaction électrostatique entre deux atomes d'une même molécule
Comment trouvez-vous la pente pour les nuls ?
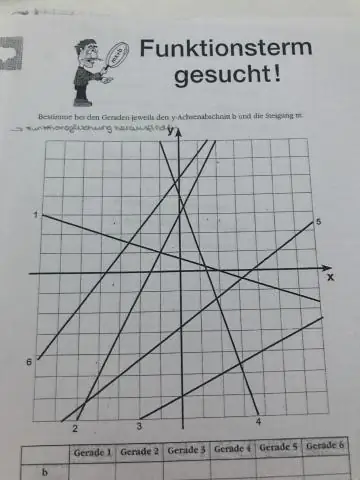
À retenir Pente = variation de y par rapport à la variation de x. Pente = (y2 - y1)/(x2 - x1) Pente = montée sur course. Vous pouvez choisir deux points sur une ligne pour calculer la pente. Vous pouvez vérifier votre réponse en essayant différents points sur la ligne. Si la droite monte, de gauche à droite, la pente est positive
Le méthane est-il une liaison covalente polaire ou non polaire ?

Le méthane (CH4) est un composé hydrocarboné non polaire composé d'un seul atome de carbone et de 4 atomes d'hydrogène. Le méthane est non polaire car la différence d'électronégativité entre le carbone et l'hydrogène n'est pas assez grande pour former une liaison chimique polarisée
