
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Divisez le nombre de moles d'eau perdu par le nombre de taupes de sel anhydre pour obtenir le rapport de l'eau molécules en unités de formule. Dans notre exemple, 0,5 moles d'eau ÷ 0.1 taupes sulfate de cuivre = 5:1 rapport . Cela signifie que pour chaque unité de CuSO4 présent, nous avons 5 molécules de l'eau.
La question est également de savoir combien de moles d'eau sont présentes par mole de CuSO4 ?
5 grains de beauté
Deuxièmement, quel est le rapport molaire de l'alun anhydre à l'eau ? Dans la première déshydratation, nous avons obtenu un rapport molaire de 1 Môle de alun à 11 taupes de l'eau . Parce que nous savons que le vrai rapport est de 1:12, on peut en déduire qu'une erreur a été commise.
On peut aussi se demander quel est le rapport du sulfate de cuivre à l'eau ?
La molaire rapport entre l'eau et le cuivre (II) sulfate sous sa forme hydratée s'est avérée être de 1: 4 973 (chapitre 2.2). Cela pourrait ensuite être arrondi à 1: 5, donnant la formule empirique du sel hydraté en question CuSO4 5 H2O.
Comment trouve-t-on le nombre de moles d'eau dans un hydrate ?
- Prenez la masse de l'hydrate et soustrayez la masse de l'anhydrate pour obtenir la masse d'eau.
- Divisez la masse d'eau par la masse molaire d'eau pour obtenir des moles d'eau.
- Divisez la masse d'anhydrate par la masse molaire d'anhydrate pour obtenir des moles d'anhydrate.
Conseillé:
Quel est le rapport entre le mot matrice et les mitochondries ?
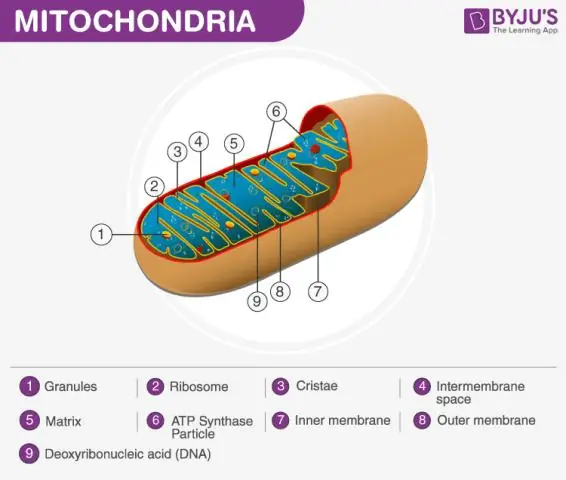
Définition de la matrice mitochondriale La mitochondrie se compose d'une membrane externe, d'une membrane interne et d'un matériau semblable à un gel appelé matrice. Cette matrice est plus visqueuse que le cytoplasme de la cellule car elle contient moins d'eau. C'est une étape importante dans la respiration cellulaire, qui produit des molécules d'énergie appelées ATP
Quel est le rapport entre le taux de croissance démographique par habitant et la taille de la population ?

Le taux de croissance de la population est mesuré en nombre d'individus dans une population (N) au cours du temps (t). Par habitant signifie par individu, et le taux de croissance par habitant implique le nombre de naissances et de décès dans une population. L'équation de croissance logistique suppose que K et r ne changent pas au fil du temps dans une population
Quel est le pourcentage massique d'eau dans l'hydrate CuSO4 5h2o ?

Une mole de CuSO4•5H2O contient 5 moles d'eau (ce qui correspond à 90 grammes d'eau) dans sa structure. Par conséquent, la substance CuSO4•5H2O est toujours constituée de 90/250 ou 36% d'eau en poids
Quel est le rapport entre l'attraction coulombienne et le rayon atomique ?

Selon la loi de Coulomb, à mesure que le numéro atomique augmente dans une série d'atomes, l'attraction nucléaire pour les électrons augmentera également, attirant ainsi le ou les électrons plus près du noyau. Une telle relation entre le numéro atomique et le rayon atomique est une corrélation directe
Quel est le rapport entre une voiture ballon et les lois de Newton ?

Les voitures à ballons reposent sur la troisième loi du mouvement de Newton. Lorsque l'air se précipite hors du ballon, il pousse la voiture vers l'avant dans la direction opposée avec une force égale
