
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Diagramme de la composition nucléaire, de la configuration électronique, des données chimiques et de la valence orbitales d'un atome de europium -152 (numéro atomique: 63), un isotope de cet élément. Le noyau est constitué de 63 protons (rouge) et 89 neutrons (orange). 63 électrons (blancs) successivement occuper couches d'électrons disponibles (anneaux).
De plus, combien de niveaux énergétiques l'europium possède-t-il ?
Zone de données
| Classification: | L'europium est un lanthanide et un métal des terres rares |
|---|---|
| Protons: | 63 |
| Neutrons dans l'isotope le plus abondant: | 90 |
| Coquilles d'électrons: | 2, 8, 18, 25, 8, 2 |
| Configuration électronique: | [Xe] 4f7 6s2 |
De même, combien d'orbitales p sont occupées dans un atome ? Comme vous pouvez le voir, les sous-niveaux 2p et 3p contiennent chacun six électrons, ce qui signifie qu'ils sont complètement occupé . Depuis chaque p sous-niveau a un total de trois p - orbitales - p X, p y, et p z - le nombre de p - orbitales occupées dans un K atome est égal à 6 - 3 p - orbitales au sous-niveau 2p et 3 p - orbitales au sous-niveau 3p.
A ce propos, combien y a-t-il de neutrons dans l'europium ?
| Nom | Europium |
|---|---|
| Nombre de protons | 63 |
| Nombre de neutrons | 89 |
| Nombre d'électrons | 63 |
| Point de fusion | 822,0°C |
Combien d'orbitales p sont remplies de fluor ?
Fluor est le neuvième élément avec un total de 9 électrons. En écrivant la configuration électronique pour fluor les deux premiers électrons iront dans les 1 orbital . Puisque les 1 ne peuvent contenir que deux électrons, les 2 électrons suivants pour F vont dans les 2 orbital . Les cinq électrons restants iront dans le 2p orbital.
Conseillé:
Combien y a-t-il de sous-ensembles dans un ensemble de 7 éléments ?

Pour chaque sous-ensemble, il peut contenir ou ne pas contenir un élément. Pour chaque élément, il y a 2 possibilités. En les multipliant ensemble, nous obtenons 27 ou 128 sous-ensembles. Pour généraliser le nombre total de sous-ensembles d'un ensemble contenant n éléments est de 2 à la puissance n
Combien y a-t-il d'électrons dans chaque sous-niveau ?

Deux électrons
Dans quel groupe appartient l'europium dans le tableau périodique ?

Europium Numéro atomique (Z) 63 Groupe groupe n/a Période période 6 Bloc f-bloc
Comment écrivez-vous sous forme de fraction sous la forme la plus simple ?
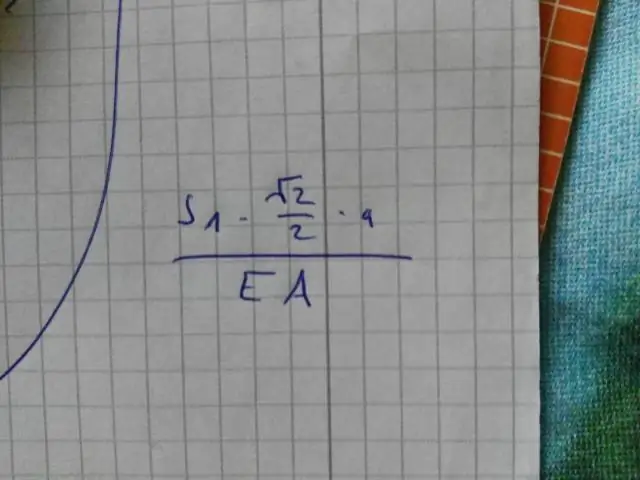
Lors de l'écriture des fractions sous la forme la plus simple, il y a deux règles à suivre : Demandez si le numérateur et le dénominateur peuvent être divisés par le même nombre, qui est appelé un facteur commun. Voir si au moins un nombre dans la fraction est un nombre premier
Combien y a-t-il de neutrons protons et d'électrons dans l'europium ?

Nom Europium Masse atomique 151.964 unités de masse atomique Nombre de protons 63 Nombre de neutrons 89 Nombre d'électrons 63
