
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Les énergie d'ionisation d'un atome est le énergie différence entre l'électron lié à l'atome et l'électron à une distance infinie de l'atome. La loi de coulomb donne l'électrique énergie potentielle entre deux charges ponctuelles avec la distance r entre elles. Les énergie est inversement proportionnel à cette distance.
En tenant compte de cela, comment l'énergie d'ionisation est-elle liée à l'énergie potentielle ?
Énergies d'ionisation des Atomes. Pour retirer un électron d'un atome, il faut élever le énergie potentielle de sa valeur négative à zéro. Selon la loi de Coulomb, nous nous attendons à ce que les électrons plus proches du noyau aient une plus faible énergie potentielle et donc exiger plus énergie à retirer de l'atome.
Par la suite, la question est, pourquoi l'énergie d'ionisation augmente-t-elle considérablement? Successif les énergies d'ionisation augmentent en amplitude parce que le nombre d'électrons, qui provoquent la répulsion, diminue régulièrement. Ainsi, le montant de énergie nécessaire pour éliminer les électrons au-delà des électrons de valence est nettement supérieur à la énergie de réactions chimiques et de liaison.
En conséquence, comment la loi de Coulomb se rapporte-t-elle à l'électronégativité ?
Selon La loi de coulomb , à mesure que le numéro atomique augmente dans une série d'atomes, l'attraction nucléaire pour les électrons volonté augmentent également, rapprochant ainsi le ou les électrons du noyau. L'attraction coulombienne du noyau d'un atome pour ses électrons est désigné comme le électronégativité de l'atome.
Qu'est-ce que l'énergie d'ionisation des atomes ?
Le premier ou l'initiale énergie d'ionisation ou Eje d'un atome ou molécule est le énergie nécessaire pour retirer une mole d'électrons d'une mole de gaz isolé atomes ou des ions. Vous pouvez penser à énergie d'ionisation comme mesure de la difficulté d'éliminer un électron ou de la force par laquelle un électron est lié.
Conseillé:
Quel est le rapport entre le mot matrice et les mitochondries ?
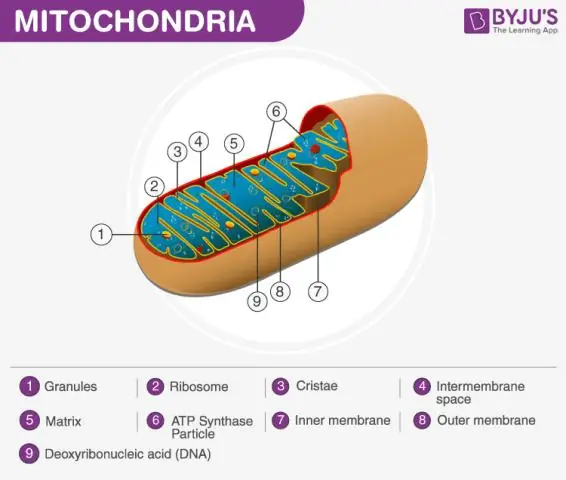
Définition de la matrice mitochondriale La mitochondrie se compose d'une membrane externe, d'une membrane interne et d'un matériau semblable à un gel appelé matrice. Cette matrice est plus visqueuse que le cytoplasme de la cellule car elle contient moins d'eau. C'est une étape importante dans la respiration cellulaire, qui produit des molécules d'énergie appelées ATP
Quel élément a la plus grande énergie d'ionisation ?

De cette tendance, le césium aurait l'énergie d'ionisation la plus faible et le fluor aurait l'énergie d'ionisation la plus élevée (à l'exception de l'hélium et du néon)
Quelle est la différence entre une loi sociétale et une loi scientifique ?

Lois de société. Les lois scientifiques sont fondées sur des preuves scientifiques étayées par l'expérimentation. Exemples de lois scientifiques. Les lois sociétales sont basées sur le comportement et la conduite de la société ou du gouvernement
Pourquoi la loi de Lenz est-elle cohérente avec la loi de conservation de l'énergie ?

La loi de Lenz est conforme au principe de conservation de l'énergie car lorsqu'un aimant avec une bobine orientée vers le pôle N est poussé vers (ou éloigné) de la bobine, il y a une augmentation (ou une diminution) de la liaison de flux magnétique, ce qui entraîne une courant circulant dans la cellule, selon la loi de Faraday
Quel est le rapport entre l'énergie des photons et la fréquence ?

L'énergie des photons. La quantité d'énergie est directement proportionnelle à la fréquence électromagnétique du photon et donc, de manière équivalente, est inversement proportionnelle à la longueur d'onde. Plus la fréquence du photon est élevée, plus son énergie est élevée. De manière équivalente, plus la longueur d'onde du photon est longue, plus son énergie est faible
