
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Comment utiliser un organigramme pour nommer un composé chimique ? À Nom une composé ou écrivez sa formule, suivez les organigrammes dans les figures 9.20 et 9.22 au bon Nom ou formule.
Par conséquent, comment nommez-vous un organigramme de composé chimique ?
- H. (Le composé est un acide.
- Prenez le nom de l'anion. Si l'anion se termine par "-ate", prenez.
- -2 (sulfate) devient.
- "sulfurique." Si l'anion se termine par "-ite", prenez.
- -2 (sulfite) devient.
- « sulfureux ». Ajoutez le mot « acide » à la fin de la racine que vous venez de créer.
On peut aussi se demander quelles sont les règles pour nommer les composés binaires ? Règles pour nommer les composés ioniques binaires
- Le nom complet du cation est indiqué en premier.
- La racine du nom de l'anion est répertoriée en deuxième et est suivie du suffixe « ide ».
- Si le composé contient un métal de transition, un chiffre romain est inclus après le nom du métal pour indiquer le nombre d'oxydation du métal.
De plus, quel est le bon ordre pour les noms et formules des composés ioniques binaires ?
Pour un composé ionique binaire , un métal sera toujours le premier élément du formule , tandis qu'un non-métal sera toujours le second. Le cation métallique est nommé en premier, suivi de l'anion non métallique. Indices dans le formule n'affecte pas le Nom.
Quels sont les exemples d'ions polyatomiques ?
En effet, la plupart ionique les composés contiennent ions polyatomiques . Bien connu exemples sont de l'hydroxyde de sodium (NaOH) avec OH- comme le polyatomique anion, carbonate de calcium (CaCO3), et le nitrate d'ammonium (NH4NON3), qui contient deux ions polyatomiques : NH+ et non3-.
Conseillé:
Comment utiliser une bandelette réactive Clorox pour une piscine ?

Test manuel Tremper une bande dans l'eau de la piscine à la profondeur du coude et la retirer immédiatement. Maintenez le niveau de la bandelette de test pendant 15 secondes et comparez-le au nuancier. Entrez les couleurs de vos résultats de test sur l'écran suivant dans les 15 secondes. Retester après deux heures d'ajout de produit à la piscine
Pour nommer un composé avec un métal de transition De quoi a-t-on besoin ?

La clé pour nommer les composés ioniques avec des métaux de transition est de déterminer la charge ionique sur le métal et d'utiliser des chiffres romains pour indiquer la charge sur le métal de transition. Écrivez le nom du métal de transition comme indiqué sur le tableau périodique. Écrivez le nom et les frais pour le non-métal
Quels sont les cinq types de preuves que vous pouvez utiliser pour déterminer si une réaction chimique s'est produite ?

Certains signes d'un changement chimique sont un changement de couleur et la formation de bulles. Les cinq conditions du changement chimique : changement de couleur, formation d'un précipité, formation d'un gaz, changement d'odeur, changement de température
Comment utiliser une réaction de neutralisation pour trouver la concentration d'une base acide ?

Un titrage est une expérience dans laquelle une réaction de neutralisation acide-base contrôlée est utilisée pour déterminer la concentration inconnue d'un acide ou d'une base. Le point d'équivalence est atteint lorsque le nombre d'ions hydrogène est égal au nombre d'ions hydroxyde
Quand devez-vous utiliser la corrélation et quand devez-vous utiliser la régression linéaire simple ?
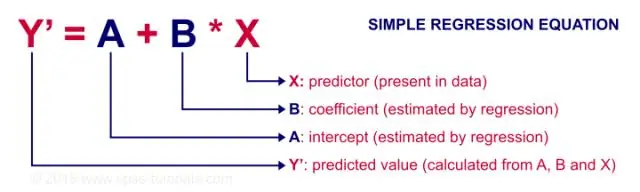
La régression est principalement utilisée pour créer des modèles/équations afin de prédire une réponse clé, Y, à partir d'un ensemble de variables prédictives (X). La corrélation est principalement utilisée pour résumer rapidement et de manière concise la direction et la force des relations entre un ensemble de 2 ou plusieurs variables numériques
