
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Si tu as besoin de utilisation cette équation , il suffit de trouver le bouton "ln" sur votre calculatrice. Vous pouvez utiliser l'équation d'Arrhenius pour montrer l'effet d'un changement de température sur la constante de vitesse - et donc sur la vitesse de la réaction. Si la constante de vitesse double, par exemple, la vitesse de la réaction le fera également.
De même, quelle est la formule de l'énergie d'activation ?
Détermination de l'énergie d'activation. Notez que lorsque l'équation d'Arrhenius est réarrangée comme ci-dessus, il s'agit d'une équation linéaire de la forme y = mx + b; y est ln(k), x est 1/T et m est -Eune/R. L'énergie d'activation de la réaction peut être déterminée en trouvant le pente de la ligne.
De plus, quelles sont les unités de K ? Du modèle de unités on peut affirmer que pour une réaction d'ordre cinétique n, la unités de k sommes: k = 1/tc^(n-1), en rappelant que c est la quantité par litre exprimée en masse ou molarité et n est l'ordre cinétique.
Alors, quelles sont les unités d'énergie d'activation dans l'équation d'Arrhenius ?
où k représente la constante de vitesse, Eune est le énergie d'activation , R est la constante des gaz (8,3145 J/K mol), et T est la température exprimée en Kelvin. A est connu comme le facteur de fréquence, ayant unités de L mol-1 s-1, et prend en compte la fréquence des réactions et la probabilité d'une orientation moléculaire correcte.
Quelle est la constante de vitesse k ?
Les constante de vitesse , k , est une proportionnalité constant qui indique la relation entre la concentration molaire des réactifs et la taux d'une réaction chimique. Les constante de vitesse peut être trouvée expérimentalement, en utilisant les concentrations molaires des réactifs et l'ordre de réaction.
Conseillé:
Comment savoir quand utiliser suvat ?

Les équations SUVAT sont utilisées lorsque l'accélération est constante et que la vitesse change. Si la vitesse est constante, vous pouvez utiliser le triangle vitesse, distance et temps. Ils peuvent être utilisés pour calculer la vitesse initiale et finale, le temps, le déplacement et l'accélération, si au moins trois quantités sont connues
Comment utiliser un Sperry DM 210a ?

Comment utiliser un compteur Sperry DM 210A Insérez le fil de test noir dans la prise COM et le fil de test rouge dans la prise V-ohm. Réglez le sélecteur de gamme du multimètre sur 600 DCV pour mesurer la tension continue ou sur 600 ACV pour la tension alternative. Touchez le fil de test noir à la terre et le fil rouge à un point sur le circuit
Quels coefficients pouvez-vous utiliser dans une équation équilibrée?

Premièrement : les coefficients donnent le nombre de molécules (ou d'atomes) impliquées dans la réaction. Dans l'exemple de réaction, deux molécules d'hydrogène réagissent avec une molécule d'oxygène et produisent deux molécules d'eau. Deuxièmement: les coefficients donnent le nombre de moles de chaque substance impliquée dans la réaction
Comment utiliser un collimateur ?
Un collimateur est un appareil qui rétrécit un faisceau de particules ou d'ondes. Se rétrécir peut signifier soit aligner davantage les directions de mouvement dans une direction spécifique (c'est-à-dire produire de la lumière collimatée ou des rayons parallèles), soit réduire la section transversale spatiale du faisceau (dispositif de limitation de faisceau)
Quand devez-vous utiliser la corrélation et quand devez-vous utiliser la régression linéaire simple ?
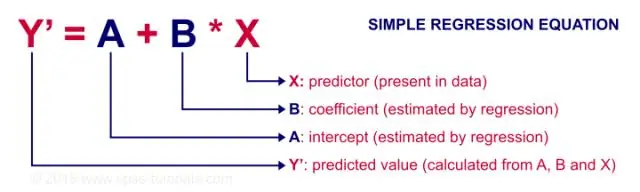
La régression est principalement utilisée pour créer des modèles/équations afin de prédire une réponse clé, Y, à partir d'un ensemble de variables prédictives (X). La corrélation est principalement utilisée pour résumer rapidement et de manière concise la direction et la force des relations entre un ensemble de 2 ou plusieurs variables numériques
