
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Isotopes ont des masses atomiques différentes. L'abondance relative de chacun isotope peut être déterminé en utilisant spectrométrie de masse . UNE spectromètre de masse ionise les atomes et les molécules avec un faisceau d'électrons à haute énergie, puis dévie les ions à travers un champ magnétique en fonction de leur Masse -rapports de charge (m / z m/z m/z).
Ici, comment les données de spectrométrie de masse démontrent-elles l'existence d'isotopes ?
Non, la plupart des éléments exister dans la nature comme différent isotopes du même élément. Lorsqu'un échantillon d'un élément pur est analysé avec un spectromètre de masse , chaque l'isotope va être ionisé et détecté. Les Masse spectre représente chaque isotope comme un pic, traçant son Masse rapport charge/charge (m/z) et son intensité relative.
Et comment calcule-t-on la masse moyenne d'un isotope ? À calculer les masse moyenne , convertissez d'abord les pourcentages en fractions (divisez-les par 100). Puis, calculer les Masse Nombres. Le chlore isotope avec 18 neutrons a une abondance de 0,7577 et un Masse nombre de 35 amu.
Par conséquent, comment la spectrométrie de masse identifie-t-elle les composés ?
Le plus haut- Masse ion dans un le spectre est normalement considéré comme l'ion moléculaire, et inférieur- Masse ions sommes fragments de l'ion moléculaire, en supposant que l'échantillon est un seul pur composé . Même si ces les composés sont de taille très similaire, il est une question simple à identifier eux de leur individu Masse spectres.
Qu'est-ce qui a une masse de 1 amu ?
Une unité de masse atomique (symbolisée AMU ou amu) est définie comme précisément 1/12 de la masse d'un atome de carbone-12. L'atome de carbone-12 (C-12) a six protons et six neutrons dans son noyau. En termes imprécis, une UMA est la moyenne des proton masse de repos et la neutron masse au repos.
Conseillé:
Quelle est la différence entre la masse d'un proton et la masse d'un électron ?
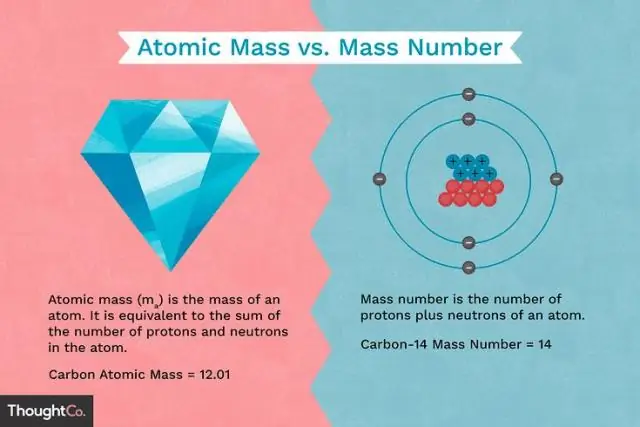
Les protons et les neutrons ont approximativement la même masse, mais ils sont tous les deux beaucoup plus massifs que les électrons (environ 2 000 fois plus massifs qu'un électron). La charge positive sur un proton est égale en amplitude à la charge négative sur un électron
Que signifie l'expression lutte pour l'existence ?

La lutte pour l'existence est une histoire naturelle [métaphore]. Il fait référence à la compétition entre les êtres vivants pour survivre. Ceci, et l'expression similaire lutte pour la vie, ont été utilisés plus de 40 fois par Charles Darwin dans l'Origine des espèces, et l'expression est le titre du chapitre 3 de l'Origine
Comment résoudre les problèmes de masse de masse des réactifs limitants ?

Trouvez le réactif limitant en calculant et en comparant la quantité de produit que chaque réactif produira. Équilibrer l'équation chimique de la réaction chimique. Convertissez les informations données en moles. Utilisez la stoechiométrie pour chaque réactif individuel pour trouver la masse de produit fabriqué
Qui a démontré que l'ADN est le matériel génétique du phage t2 ?

Hershey et Chase ont fait une série d'expériences classiques démontrant que l'ADN est le matériel génétique du phage T2
Lequel des articles de 1905 a donné la première bonne preuve théorique de l'existence des atomes ?

Papiers Annus mirabilis
