
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
La géométrie moléculaire du BCl3 est trigonale plane avec une distribution de charge symétrique autour de l'atome central. Cette molécule est donc apolaire.
Aussi, quelle est la structure de BCl3 ?
BCl3 est une molécule plane trigonale comme les autres trihalogénures de bore, et a une longueur de liaison de 175 pm. Notez que le bore peut avoir une enveloppe extérieure complète avec seulement six électrons de valence. Dans le Lewis structure pour BCl3 l'atome central (Bore) n'aura que six électrons de valence.
De même, BCl3 est-il polaire ou non polaire ? trichlorure de bore, ou BCl3 , est non polaire . Les trois atomes de chlorure ont une charge négative et le bore au centre a une charge égale mais positive. Le bore se trouve au centre de la molécule et possède trois électrons de valence, il équilibre donc les trois chlorures.
En gardant cela à l'esprit, pourquoi BCl3 a-t-il une forme plane trigonale ?
BCl3 a 3 liaisons simples B-Cl et aucune paire isolée autour de B, d'où 6 électrons de valence autour de B. Selon la notation VSEPR, cette molécule prend la notation AX3. La géométrie de BCl3 est trigonale plane . AlCl3 a 3 liaisons simples Al-Cl et aucune paire isolée autour d'Al, donc 6 électrons de valence autour d'Al.
Quel est l'angle de liaison dans BCl3 ?
BCl3 Géométrie Moléculaire Et Angles de liaison Si nous regardons la structure, BCl3 la géométrie moléculaire est planaire trigonale. Les angle de liaison est 120o.
Conseillé:
Quelle est la forme la plus simple pour 6 20 ?

Simplifiez 6/20 à la forme la plus simple. Calculateur de fractions simplifié en ligne pour réduire rapidement et facilement 6/20 aux termes les plus bas. 6/20 Réponse simplifiée : 6/20 = 3/10
Comment convertir la forme générale en forme standard d'une hyperbole ?

La forme standard d'une hyperbole qui s'ouvre latéralement est (x - h)^2 / a^2 - (y - k)^2 / b^2 = 1. Pour l'hyperbole qui s'ouvre en haut et en bas, c'est (y - k) ^2 / a^2 - (x- h)^2 / b^2 = 1. Dans les deux cas, le centre de l'hyperbole est donné par (h, k)
Comment écrivez-vous sous forme de fraction sous la forme la plus simple ?
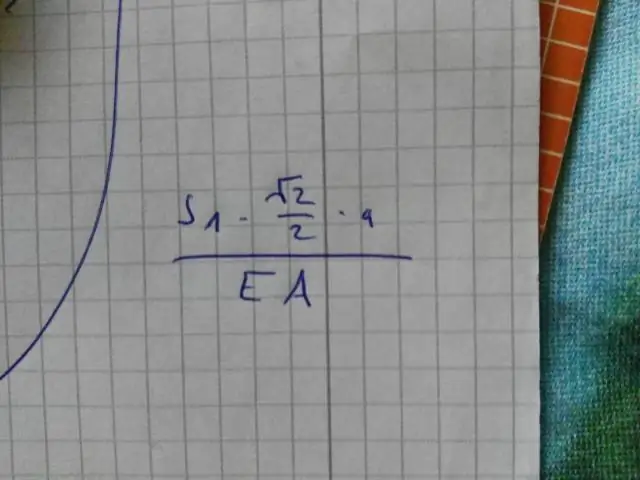
Lors de l'écriture des fractions sous la forme la plus simple, il y a deux règles à suivre : Demandez si le numérateur et le dénominateur peuvent être divisés par le même nombre, qui est appelé un facteur commun. Voir si au moins un nombre dans la fraction est un nombre premier
Comment écrivez-vous la forme d'interception de pente sous forme standard?

La forme standard est une autre façon d'écrire la forme à l'origine de la pente (par opposition à y=mx+b). Il s'écrit Ax+By=C. Vous pouvez également changer la forme d'interception de pente en forme standard comme ceci : Y=-3/2x+3. Ensuite, vous isolez l'ordonnée à l'origine (dans ce cas c'est 2) comme ceci : Ajoutez 3/2x de chaque côté de l'équation pour obtenir ceci : 3/2x+y=3
Comment convertir une équation quadratique de la forme générale à la forme standard ?

Toute fonction quadratique peut être écrite sous la forme standard f(x) = a(x - h) 2 + k où h et k sont donnés en termes de coefficients a, b et c. Commençons par la fonction quadratique sous forme générale et complétons le carré pour la réécrire sous forme standard
