
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-11-26 05:37.
- Dernière modifié 2025-01-22 16:58.
Vous pouvez afficher plus de détails sur chaque unité de mesure: poids moléculaire de Californie ( OH ) 2 ou grammes Ce composé est également connu sous le nom Calcium Hydroxyde. L'unité de base SI pour la quantité de substance est la Môle . 1 Môle est égal à 1 taupes Ca ( OH ) 2 , soit 74,09268 grammes.
A côté de cela, quelle est la masse d'une mole de Ca Oh 2 ?
Réponse et explication: La molaire Masse de calcium hydroxyde, c'est-à-dire Californie ( OH ) 2 est de 74 grammes par Môle (g/mol).
De plus, quelle est la masse de 1,5 mole de co2 ? Réponse: Il y a 66 g CO2 dans 1,5 mole de CO2.
Compte tenu de cela, quelle est la masse de 0,50 mol de Ca Oh 2 ?
Les masse molaire de calcium hydroxyde, Californie ( OH ) 2 , est de 74,092 g/ mole.
Combien y a-t-il de moles dans 4,5 kg de Ca Oh 2 ?
61 grains de beauté
Conseillé:
Quelle est la masse de 0,921 mole de dioxyde de soufre gazeux ?

L'unité de base SI pour la quantité de substance est la mole. 1 mole équivaut à 1 mole de dioxyde de soufre, soit 64,0638 grammes
Quelle est la loi de conservation de la masse et pourquoi est-elle importante ?

La loi de conservation de la masse est très importante pour l'étude et la production de réactions chimiques. Si les scientifiques connaissent les quantités et les identités des réactifs pour une réaction particulière, ils peuvent prédire les quantités de produits qui seront fabriqués
Quelle est la différence entre la masse d'un proton et la masse d'un électron ?
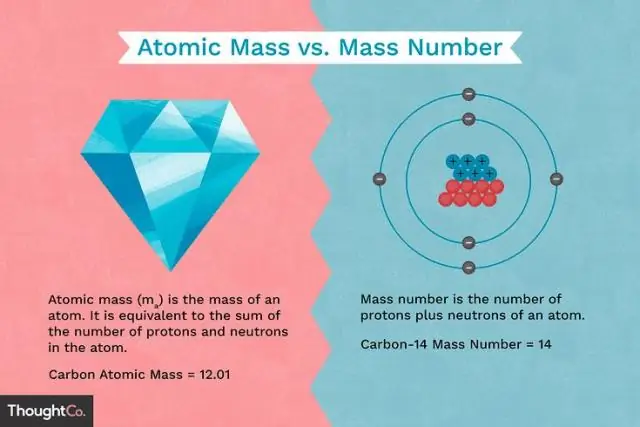
Les protons et les neutrons ont approximativement la même masse, mais ils sont tous les deux beaucoup plus massifs que les électrons (environ 2 000 fois plus massifs qu'un électron). La charge positive sur un proton est égale en amplitude à la charge négative sur un électron
Quelle est la masse d'une mole d'or ?

196.96655 grammes
Comment résoudre les problèmes de masse de masse des réactifs limitants ?

Trouvez le réactif limitant en calculant et en comparant la quantité de produit que chaque réactif produira. Équilibrer l'équation chimique de la réaction chimique. Convertissez les informations données en moles. Utilisez la stoechiométrie pour chaque réactif individuel pour trouver la masse de produit fabriqué
