- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Alors on calculer en prenant le poids Masse de chacun des isotopes et en les additionnant. Alors, pour la première Masse , on multipliera 0,50% de 84 (amu - masse atomique unités) = 0,042 amu, et l'ajouter à 9,9% de 86 amu = 8,51 amu, et ainsi de suite.
Par la suite, on peut aussi se demander, comment calculez-vous la masse atomique moyenne ?
Calcul de la masse atomique moyenne Les masse atomique moyenne d'un élément est la somme des masses de ses isotopes, chacun multiplié par son abondance naturelle (la décimale associée au pourcentage de atomes de cet élément qui sont d'un isotope donné). Masse atomique moyenne = f1M1 + f2M2 +…
Sachez également quels sont les trois types d'informations nécessaires pour calculer une masse atomique moyenne ? Le nombre d'isotopes qui existent pour l'élément. Les Atomique Numéro pour l'élément. Le pourcentage d'abondance de chaque isotope.
On peut aussi se demander quelle valeur est la plus proche de la masse atomique du strontium ?
Strontium . Dans son rapport de 1961, la Commission a recommandé Ar(Sr) = 87,62 sur la base du Masse -détermination spectrométrique de Nier. Cette valeur a été révisé en Ar(Sr) = 87,62(1) en 1969 et il reste inchangé depuis.
Qu'est-ce qui a une masse de 1 amu ?
Une unité de masse atomique (symbolisée AMU ou amu) est définie comme précisément 1/12 de la masse d'un atome de carbone-12. L'atome de carbone-12 (C-12) a six protons et six neutrons dans son noyau. En termes imprécis, une UMA est la moyenne des proton masse de repos et la neutron masse au repos.
Conseillé:
Quelle est la masse atomique moyenne d'un atome ?

La masse atomique moyenne d'un élément est la somme des masses de ses isotopes, chacun multiplié par son abondance naturelle (la décimale associée au pourcentage d'atomes de cet élément qui appartiennent à un isotope donné). Masse atomique moyenne = f1M1 + f2M2 +
Comment calculer la moyenne de population dans Excel ?
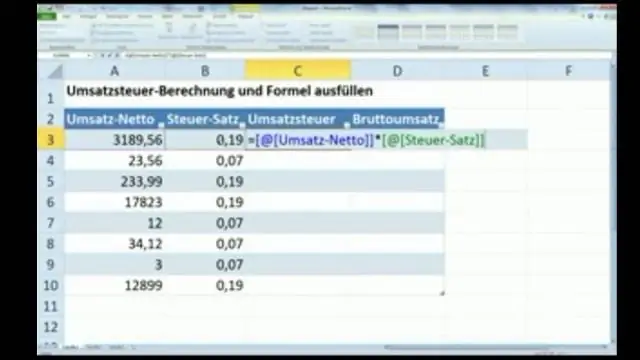
Moyenne de la population = somme de tous les éléments / nombre d'éléments Moyenne de la population = (14+61+83+92+2+8+48+25+71+12) / 10. Moyenne de la population = 416 / 10. Moyenne de la population = 41,6
Comment calculer la masse et le centrage d'un avion ?

Additionnez tous les moments pour trouver le moment total. Divisez le moment total par le poids brut pour trouver le centre de gravité. Localisez la masse totale et le centre de gravité sur le tableau des limites de centre de gravité dans le POH de votre avion pour déterminer si l'avion est dans les limites autorisées
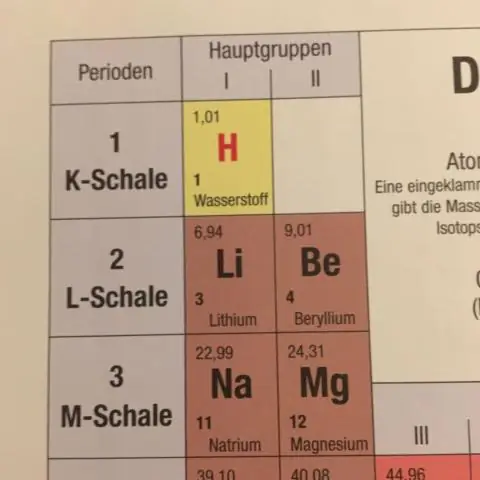
Comment la masse atomique moyenne indiquée sur le tableau périodique est-elle déterminée?
La masse atomique moyenne d'un élément est calculée en additionnant les masses des isotopes de l'élément, chacun multiplié par son abondance naturelle sur Terre. Lorsque vous effectuez des calculs de masse impliquant des éléments ou des composés, utilisez toujours la masse atomique moyenne, qui peut être trouvée dans le tableau périodique
Pourquoi le tableau périodique est-il organisé par numéro atomique et non par masse atomique ?

Pourquoi le tableau périodique est-il organisé par numéro atomique et non par masse atomique ? Le numéro atomique est le nombre de protons dans le noyau des atomes de chaque élément. Ce numéro est unique à chaque élément. La masse atomique est déterminée par le nombre de protons et de neutrons combinés
