
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-01-22 16:58.
Ici, nous devons casser le C=C lier dans l'éthène, et le H-H lier en H2. (Voir Énergie de liaison tableau en bas de cette page) A H-H lier l'enthalpie (BE) est de 436 kJ/mol, un C=C lier est de 602 kJ/mol, un liaison C-C est de 346 kJ/mol, et un C-H BE est de 413 kJ/mol.
De même, on demande quelle est l'énergie de dissociation des liaisons pour CC ?
Énergies de liaison communes (D
| Lier | D (kJ/mol) | r (après-midi) |
|---|---|---|
| C-C | 346 | 154 |
| C=C | 602 | 134 |
| C≡C | 835 | 120 |
| C-Si | 318 | 185 |
Sachez également, quelle est l'énergie de liaison du CO? Les énergie de liaison de C=O, c'est-à-dire le énergie changer pour la réaction CO (g) → C(g) + O(g) vaut 1079 kJ/mol. C'est le plus fort lier connu pour une molécule diatomique. Mais c'est atypique dans un sens, puisqu'il s'agit plutôt d'un triple lier qu'un double lier.
De cette façon, comment calculez-vous l'énergie de liaison?
Énergie de liaison est défini par la somme de tous les obligations brisé moins la somme de tous les obligations formé: ΔH = ∑H( obligations cassé) - H( obligations formé). ΔH est la variation de énergie de liaison , également appelé le lier enthalpie et ∑H est la somme des énergies de liaison pour chaque côté de l'équation.
Quelle liaison est plus forte CC ou CO ?
Comment est la Lien C-O plus fort que le liaison C-C , mais le C-N lier est plus faible que ces deux obligations ? Il est logique que CO est plus forte que C-C . La différence d'électronégativité est plus grande, ce qui augmente le caractère ionique tandis que l'atome d'oxygène est plus petit, ce qui augmente le chevauchement orbital.
Conseillé:
Quelle est la différence entre l'énergie de liaison et l'énergie de dissociation de liaison?

Le différence principale entre l'énergie de liaison et l'énergie de dissociation des liaisons est que l'énergie de liaison est la quantité moyenne d'énergie nécessaire pour briser toutes les liaisons entre les deux mêmes types d'atomes dans un composé tandis que l'énergie de dissociation des liaisons est la quantité d'énergie nécessaire pour briser une inhomolyse de liaison particulière
Une liaison hydrogène est-elle la même chose qu'une liaison covalente?
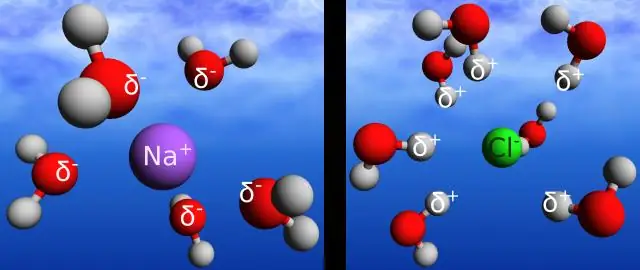
La liaison hydrogène est le nom donné à l'interaction électrostatique entre la charge positive sur un atome d'hydrogène et la charge négative sur l'atome d'oxygène d'une molécule voisine. La liaison covalente est l'interaction électrostatique entre deux atomes d'une même molécule
Quelle est la liaison du chlore?

Le chlore est un non-métal. Un atome de chlore a 7 électrons dans sa couche externe. avec d'autres atomes de chlore. Une paire d'électrons partagés forme une seule liaison covalente
Quelle liaison est plus forte hydrogène ou van der Waals ?

Les liaisons hydrogène sont généralement plus fortes que les forces de Van der Waals. Ces liens sont durables et assez forts. Les forces de Van der Waals sont basées sur des dipôles temporaires qui se forment alors que les molécules sont dans un état de flux ou de mouvement
Quelle est la capacité de liaison pour la construction?

Détermination de la capacité de liaison de votre entreprise. La capacité de cautionnement est le montant maximal du crédit de cautionnement qu'une société de cautionnement fournira à un entrepreneur. Il est généralement exprimé en termes du plus gros projet que la caution serait disposée à émettre et du montant maximal de l'arriéré de contrats qu'un entrepreneur peut détenir
