
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Dernière modifié 2025-06-01 05:04.
Basicité. Par rapport aux amines, amides sont des bases très faibles. Alors que l'acide conjugué d'une amine a un pKune d'environ 9,5, l'acide conjugué d'un amide a un pKune environ -0,5. Par conséquent, amides n'ont pas des propriétés acido-basiques aussi clairement perceptibles dans l'eau.
Également demandé, quel est le pKa d'une amine ?
La valeur de 10,63 se réfère en fait à la pKa de l'acide conjugué de méthyle amine , PAS la méthylamine elle-même. C'est une valeur pKaH. De même, le même tableau répertorie la triméthylamine comme ayant un pKa de 9,8.
De plus, les amides peuvent-ils être protonés? UNE amide protoné possède le groupe le moins acide de tous (CONH+), preuve que la forme de résonance clignotante a dans ce cas une contribution écrasante. La paire d'électrons isolés sur NH2 est très délocalisée au groupe carbonyle dans amides . En fait, le C=O. groupe d'un amide est plus basique que le NH2.
De même, vous pouvez demander, quel est le pKa de l'hydroxyde ?
Hydroxyde ion, HO(-) n'est pas sur le côté gauche de la pKa table, mais c'est à l'envers pKa table - c'est la base conjuguée de l'eau, H2O. L'eau a un pKa de ~15, et CH4 a un pKa de 50. Notre produit est un acide plus fort. De l'inverse pKa tableau, on note également que CH3(-) est une base plus forte que HO(-).
Pourquoi les amides sont-ils basiques ?
Contrairement aux amines, qui sont des bases décentes, amides sont des bases faibles. Les acides conjugués de amides ont des valeurs de pKa d'environ -0,5. La raison amides ne sont pas aussi de base est due à la présence des groupes carbonyle. Amides peuvent également créer une liaison hydrogène car ils contiennent une liaison N-H.
Conseillé:
Quel est le pKa des acides forts ?

Les acides forts sont définis par leur pKa. L'acide doit être plus fort en solution aqueuse qu'un ion hydronium, donc son pKa doit être inférieur à celui d'un ion hydronium. Par conséquent, les acides forts ont un pKa de <-174
Quel est le nom du produit chimique où l'énergie est stockée pendant la première phase de la photosynthèse ?
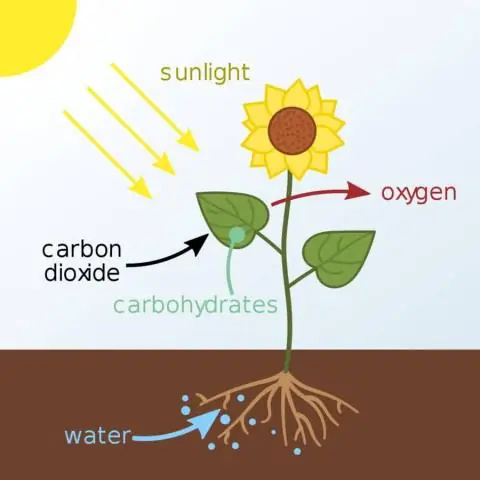
Les réactions dépendantes de la lumière utilisent l'énergie lumineuse pour fabriquer deux molécules nécessaires à la prochaine étape de la photosynthèse : la molécule de stockage d'énergie ATP et le transporteur d'électrons réduit NADPH. Chez les plantes, les réactions lumineuses ont lieu dans les membranes thylakoïdes des organites appelées chloroplastes
Quel est le pKa approximatif d'un thiol ?

6.4 Également demandé, quel est le pKa du thiol ? Thiols sont plus acides que les alcools en moyenne d'environ 5 pKa unités environ ( pKa d'environ 11 pour le thiol illustré ci-dessous). Rappelez-vous que pKa est logarithmique, ce qui signifie qu'ils sont d'environ 10 5 fois plus acide.
Qu'est-ce qu'un amide en chimie?

Un amide est un groupe fonctionnel contenant un groupe carbonyle lié à un atome d'azote ou tout composé contenant le groupe fonctionnel amide. Les amides sont dérivés de l'acide carboxylique et d'une amine. L'amide est aussi le nom de l'anion inorganique NH2
Comment déterminez-vous quel acide est plus fort en fonction du pKa ?

Utilisez le principe « Plus l'acide est faible, plus la base conjuguée est forte » pour obtenir les forces des bases à partir d'une table pKa. Voici le principe clé : l'ordre de la force basique est l'inverse de la force acide. Plus l'acide est faible, plus la base conjuguée est forte
